cac2电子式,碳化钙的化学式怎么写(推断题,学霸都在用的解题神技)
关于【cac2电子式】,碳化钙的化学式怎么写,今天犇涌小编给您分享一下,如果对您有所帮助别忘了关注本站哦。
- 内容导航:
- 1、推断题,学霸都在用的解题神技
- 2、cac2电子式:碳化钙的化学式怎么写
1、推断题,学霸都在用的解题神技
无机推断题的形式通常有文字描述推断、文字描述与反应式结合推断和框图题等。无机推断题是集元素化合物、基本概念和基本理论于一体,且综合性强、考查面广、容量大、题型多变、要求高、推理严密,既能检查掌握元素化合物的量及熟练程度,又能考查的逻辑。
无机推断题考查内容及命题主要呈现如下趋势:
1.限定范围推断:
主要适用于气体或离子的推断,该类题目的主要特点是在一定范围内,根据题目给出的实验现象(或必要的数据)进行分析,作出正确判断。
解题关键:
①审明题意,明确范围,注意题目所给的限定条件;
②紧扣现象,正确判断;
③要注意数据对推断结论的影响。
2.不定范围推断:
常见元素化合物的推断。该题目的主要特点是:依据元素化合物之间相互转化时所产生的一系列实验现象,进行推理判断,确定有关的物质。题目往往综合性较强,具有一定的难度。从形式来看,有叙述型、图表型等。
解题关键:
见题后先迅速浏览一遍,由模糊的一遍“扫描”,自然地在头脑中产生一个关于该题所涉及知识范围等方面的整体印象,然后从题中找出特殊现象或特殊性质的描述,作为解题的突破口,进而全面分析比较,作出正确判断。
3.给出微粒结构等的微粒(或元素)推断题。
解题关键:
①熟记元素符号,直接导出;
②掌握几种关系,列式导出;
③利用排布规律,逐层导出;
④弄清带电原因,分析导出;
⑤抓住元素特征,综合导出;
⑥根据量的关系,计算导出。
4.给出混合物可能组成的框图型(或叙述型)推断题。
解题关键:
解框图型(或叙述型)推断题一般是根据物质的转化关系,从其中一种来推知另一种(顺推或逆推),或找出现象明显、易于推断的一种物质,然后左右展开;有时需试探求解,最后验证。
5.给出物质间转化关系的代码型推断题。
解题关键:
此类推断题的特点是用代号表示各物质的转化关系,要求“破译”出各物质的分子式或名称等,看起来较复杂,其实在解题时,只要挖掘题眼,顺藤摸瓜,便可一举攻克。
6.给出物质范围的表格型推断题。
解题关键:
列表分析,对号入座;直观明快,谨防漏解。
总之,解无机推断题的步骤是:
①读审。仔细读题、审清题意。即弄清题意和要求,明确已知和未知条件,找出明显条件和隐蔽条件。
②找突破口或“题眼”。通过分析结构特征、性质特征、反应特征和现象特征及特征数据等等,确定某一物质或成分的存在,以此作解题突破口。
③推理。从突破口向外扩展,通过顺推法、逆推法、假设法得出初步结论,最后作全面检查,验证推论是否符合题意。
练习:
1.(2019·漳州调研)已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:
(1)D的化学式是__________,E的化学式是_________________________________________。
(2)A和B反应生成C的化学方程式是______________________________________________。
(3)E和F反应生成D、H和G的化学方程式是_______________________________________。
1.(1)NH3 NH4Cl (2)H2+Cl2点燃2HCl
(3)2NH4Cl+Ca(OH)2△CaCl2+2NH3↑+2H2O
解析 本题的突破口为“D(气体)→E(固体)→D(气体)”这一系列转化过程,可联想到中学化学中“氨气→铵盐→氨气”这一转化过程,据此可推测D为NH3,结合G为CaCl2,可知E为NH4Cl,F为Ca(OH)2。其余物质可以逐一确定:A为H2(或Cl2),B为Cl2(或H2),C为HCl,H为H2O。
2.下图中每一方框的字母代表一种反应物或生成物:
已知气态烃D(其密度在同温同压下是氢气密度的13倍)跟物质F反应时产生明亮而带浓烟的火焰。请写出下列字母代表的物质的化学式(分子式):
A____________、B____________、C____________、
D____________、E____________、H____________。
2.CaC2 H2O Ca(OH)2 C2H2 CO2 Ca(HCO3)2
解析 据同温同压下,两气体的密度之比等于其相对分子质量之比,可计算出气态烃D的相对分子质量为26,即D为C2H2。根据D与F反应时产生明亮而带浓烟的火焰,可推断F为O2。由D+F→E+B(C2H2+O2→CO2+H2O)、A+B→C+D[CaC2+H2O→Ca(OH)2+C2H2]可确定A、B、C、E分别为CaC2、H2O、Ca(OH)2、CO2。进而可确定G为CaCO3、H为Ca(HCO3)2。
3.下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
请按要求回答:
(1)写出B的化学式_______________________,G的电子式__________________________。
(2)反应①的离子方程式为_______________________________________________________。
(3)反应②进行的条件是_____________、_____________。
(4)反应③的化学方程式为_______________________________________________________。
3.(1)Al
(2)Al3++3AlO-2+6H2O===4Al(OH)3↓ (3)光照 过量Cl2 (4)Al4C3+12H2O===3CH4↑+4Al(OH)3↓
4.(2020·黄冈调研)已知A~I均为中学化学中的常见物质,它们之间的转化关系如图所示,其中A、D为金属单质,反应过程中需要或生成的水及其他部分产物已略去。
请回答以下问题:
(1)B和F分别是____________________(填化学式)。
(2)写出下列反应的化学方程式。
①A与B在高温下反应:_________________________________________________________。
②H在空气中转化为I:__________________________________________________________。
(3)E溶液中所有离子浓度由大到小的顺序是_______________________________________。
(4)用离子方程式表示G溶液呈酸性的原因:________________________________________
______________________________________________________________________________;
该反应的平衡常数为_____________________________________________________________
(已知常温下,H的溶度积常数Ksp=8.0×10-16)。
4.(1)Fe2O3、Al(OH)3 (2)①Fe2O3+2Al高温2Fe+Al2O3
②4Fe(OH)2+2H2O+O2===4Fe(OH)3
(3)c(Na+)>c(AlO-2)>c(OH-)>c(H+)
(4)Fe2++2H2OFe(OH)2+2H+ 1.25×10-13
解析 根据框图中转化关系及题干信息,可以确定I为氢氧化铁。A、D为金属单质,根据A和B的反应条件就可以联想到铝热反应,推测A、D分别为铝和铁,则B为氧化铁,C为氧化铝,E为偏铝酸钠,G为氯化亚铁,F为氢氧化铝,H为氢氧化亚铁。偏铝酸钠水解使溶液呈碱性,所以溶液中离子浓度的大小顺序为c(Na+)>c(AlO-2)>c(OH-)>c(H+);FeCl2溶液中,Fe2+发生水解:Fe2++2H2OFe(OH)2+2H+,平衡常数K=c2H+cFe2+=c2H+·c2OH-cFe 2+·c2OH-=1.0×10-1428.0×10-16=1.25×10-13。
5.以下一些氧化物和单质之间可发生如下图所示的反应:其中,氧化物Ⅰ是红棕色固体,氧化物Ⅱ、Ⅲ、Ⅳ在反应条件下都是气体。
(1)氧化物Ⅰ的化学式是__________,氧化物Ⅱ的化学式是____________。
(2)反应①的化学方程式是_______________________________________________________;反应②的化学方程式是__________________________________________________________;反应③的化学方程式是__________________________________________________________。
5.(1)Fe2O3 CO
(2)Fe2O3+3CO高温2Fe+3CO2
CO+H2O(g)高温CO2+H2
C+H2O(g)高温CO+H2
6.A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。化合物F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下图(图中部分产物未列出):
请填写下列空白:
(1)A是________,C是________。
(2)H与盐酸反应生成E的化学方程式是____________________________________________。
(3)E与F反应的化学方程式是____________________________________________________。
(4)F与G的水溶液反应生成I和D的离子方程式是__________________________________。
6.(1)碳(或C) 钠(或Na) (2)Na2CO3+2HCl===2NaCl+H2O+CO2↑ (3)2CO2+2Na2O2===2Na2CO3+O2 (4)Na2O2+S2-+2H2O===4OH-+S↓+2Na+
7.中学化学中几种常见物质的转化关系如下:
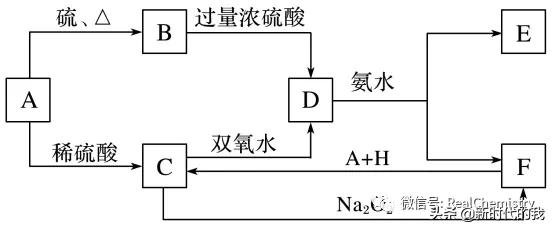
将D溶液滴入沸水中可得到以F为分散质的红褐色胶体。请回答下列问题:
(1)红褐色胶体中F粒子直径大小的范围:___________________________________________。
(2)写出A、B、H的化学式:A________、B________、H________。
(3)①H2O2分子的电子式:________________________________________________________。
②写出C的酸性溶液与双氧水反应的离子方程式:
______________________________________________________________________________。
(4)写出鉴定E中阳离子的实验方法和现象:______________________________________________________________________________。
(5)在C溶液中加入与C等物质的量的Na2O2,恰好使C转化为F,写出该反应的离子方程式:__________________________________________________________________________。
7.(1)1~100 nm (2)Fe FeS H2SO4
(3)①H·×O······O·····×H ②2Fe2++H2O2+2H+===2Fe3++2H2O
(4)取少量E于试管中,用胶头滴管滴入NaOH溶液,加热试管,可观察到试管口处湿润的红色石蕊试纸变蓝(或其他合理答案)
(5)4Fe2++4Na2O2+6H2O===4Fe(OH)3↓+O2↑+8Na+
8.已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16。在一定条件下,各物质相互转化关系如下图所示:
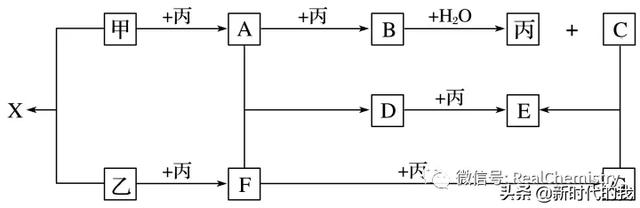
(1)写出X的电子式和G的化学式:X______________,G________________。
(2)写出有关变化的化学方程式:
B+H2O:______________________________________________________________________;
D+丙:_______________________________________________________________________。
8.(1)Na+[··S······]2-Na+ SO3 (2)2Na2O2+2H2O===4NaOH+O2↑ 2Na2SO3+O2===2Na2SO4
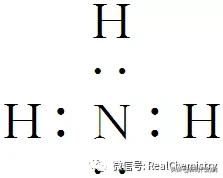
9.(2019·安庆质检)有一化合物X,其水溶液为浅绿色,可发生如下的转化关系(部分反应物、生成物已略)。其中B、D、E、F均为无色气体,M、L为常见的金属单质,C为难溶于水的红褐色固体。在混合液中加入BaCl2溶液可生成不溶于稀盐酸的白色沉淀,H和M反应可放出大量的热。

请回答下列问题:
(1)B的电子式为__________________。
(2)画出元素M的原子结构示意图_________________________________________________。
(3)物质X的化学式为___________________________________________________________。
(4)电解混合液时阳极反应式为______________________________________________________________________________。
(5)按要求写出上述转化关系中有关反应的化学方程式:
①含有L元素的化合反应:______________________________________________________________________________。
②含有L元素的置换反应:______________________________________________________________________________。
(6)已知a g E气体在D中完全燃烧生成稳定的化合物时,放出bkJ的热量,写出E气体燃烧热的热化学方程式为__________________________________________________________。
9.(1)
(2)

(3)(NH4)2Fe(SO4)2 (4)4OH--4e-===O2↑+2H2O
(5)①4Fe(OH)2+O2+2H2O===4Fe(OH)3
②Fe2O3+2Al高温2Fe+Al2O3
(6)H2(g)+12O2(g)===H2O(l) ΔH=-2ba kJ·mol-1
2、cac2电子式:碳化钙的化学式怎么写
碳化钙的化学式怎么写
碳化钙不是盐,它是一种无机化合物。
碳化钙:别称电石、乙炔钙、嘎石,化学式为CaC2。碳化钙是电石的主要成分,是一种无机化合物,白色晶体。工业品为灰黑色块状物,断面为紫色或灰色。遇水立即发生激烈反应,生成乙炔,并放出热量。碳化钙是重要的基本化工原料,主要用于产生乙炔气。也用于有机合成、氧炔焊接等。
碳化钙要储存于阴凉、干燥、通风良好的库房,并远离火种、热源。相对湿度要求保持在75%以下,其包装必须密封,切勿受潮。应与酸类、醇类等分开存放,切忌混储。储区应备有合适的材料收容泄漏物。
碳化钙的物理性质
碳化钙,即电石,无机化合物。无色晶体,工业品为灰黑色块状物,断面为紫色或灰色。遇水立即发生激烈反应,生成乙炔,并放出热量。碳化钙是重要的基本化工原料,主要用于产生乙炔气。也用于有机合成、氧炔焊接等。中文名称: 碳化钙英文名称: calcium carbide中文名称2: 电石英文名称2: acetylenogenCAS No.: 75-20-7分子式: CaC2电子式:Ca2+[:C≡C:]2- 中间的“≡”代表三对共用电子对分子量: 64.10EINECS号: 200-848-3InChI: InChI=1/C2. Ca/c1-2;/q-2;+2熔点: 447℃密度: 2.22沸点: 2300℃
理化性质:黄褐色或黑色的块状固体, 电石-石灰相平衡图纯品为无色晶体(含CaC2较高的是紫色)。密度2.22克/立方厘米,熔点447℃、沸点2300℃,遇水立即发生激烈反应,生成乙炔,并放出热量,电石含量不同熔点也随之变化。杂质:因电石中常含有砷化钙(Ca3 As2)、磷化钙(Ca3 P2)等杂质,与水作用时同时放出砷化氢(AsH3 )、磷化氢(PH3 )等有毒气体,因此使用由电石产生的乙炔有毒(须通过浓H2SO4和重铬酸钾洗液除去)。相对密度(水=1): 2.22
碳化钙是由什么构成
碳化钙(英文:Calcium carbide)是电石的主要成分,
异名乙炔钙,化学式CaC2。电石是一种呈绿色或灰黑
色的粉末或块状固体,带有大蒜味,工业上常用电石与
水混合制取乙炔气体;亦被应用于冶炼工业,作为还原
剂和脱硫剂,但是如果加入了过量的水,就绝对不能触
摸残留的化合物,因为这种化合物是强碱氢氧化钙(Ca(OH)2)。
本文关键词:碳化钙化学式是什么,碳化钙的方程式,碳化钙的化学性质,碳化钙的结构式怎么写,碳化钙化学式化合价。这就是关于《cac2电子式,碳化钙的化学式怎么写(推断题,学霸都在用的解题神技)》的所有内容,希望对您能有所帮助!更多的知识请继续关注《犇涌向乾》百科知识网站:http://www.029ztxx.com!
版权声明: 本站仅提供信息存储空间服务,旨在传递更多信息,不拥有所有权,不承担相关法律责任,不代表本网赞同其观点和对其真实性负责。如因作品内容、版权和其它问题需要同本网联系的,请发送邮件至 举报,一经查实,本站将立刻删除。

