苄叉丙酮的简介,苄叉丙酮的合成(ppm级催化剂负载量的不对称有机催化反应)
关于【苄叉丙酮的简介】,苄叉丙酮的合成,今天犇犇小编给您分享一下,如果对您有所帮助别忘了关注本站哦。
1、Benjamin List课题组:ppm级催化剂负载量的不对称有机催化反应
手性叔醇结构广泛存在于各种天然产物和药物分子中(图1a),羟醛缩合(aldol)反应是合成该类结构的重要方法。尽管醛的催化不对称aldol反应取得了相当大的进展,但迄今为止,只有少数几例使用酮作为亲电试剂的报道。酮的aldol反应是热力学不利的,加上酮的反应活性比醛的低,使其在动力学方面同样遇到困难。虽然酮参与的Mukaiyama aldol反应正向有利,但相应的对映选择性过程仍然比醛更具挑战性。Denmark课题组报道了首例手性双N-氧化物作为Lewis碱催化酮的Mukaiyama aldol反应,该方法需要使用高活性的乙酸甲酯的三氯硅烷烯醇酯作为亲核试剂(图1b)。Shibasaki和Kanai团队发展了膦配体配位的Cu(I)催化剂的参与下,三甲基硅基烯醇化物与酮的对映选择性Mukaiyama aldol反应(图1b)。除此之外,Campagne课题组还报道了手性BINAP配体配位的Cu(II)催化体系,实现了酮的乙烯类型的Mukaiyama aldol反应。这类反应通常需要较高的催化剂负载量,底物的适用范围也相对受限。
德国马克斯•普朗克煤炭研究所的Benjamin List教授课题组近年来在基于硅阳离子的抗衡阴离子导向不对称Lewis酸催化(silylium ACDC)的Mukaiyama反应中取得了显著进展。不久前,他们利用最近发展的亚氨基双磷酰亚氨酸酯(IDPi)催化剂独特的催化活性,发展了更为高效的烯酮缩硅基甲基醇与一系列酮的不对称Mukaiyama aldol反应,以优秀的产率和对映选择性得到相应的手性叔醇产物,催化剂的负载量仅为ppm量级。相关工作发表在Nature Chemistry 上。
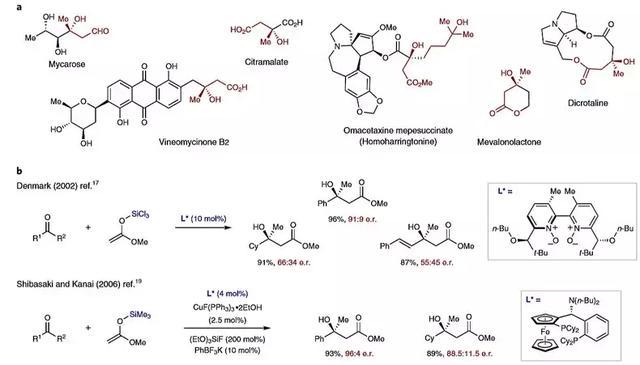
图1. 含有叔醇结构的代表性天然产物及叔醇的不对称合成。图片来源:Nat. Chem.
首先,作者选择烯酮缩硅基甲基醇2a对2-乙酰萘酮1a的加成反应作为模板反应对反应条件进行筛选(图2),在0.1 mol%的手性二磺酰亚胺(DSI)催化剂C-1的条件下,即使反应24 h,体系中也没有检测到目标产物,只得到了烯醇硅醚4。而在0.1 mol%的IDPi催化剂C-2的条件下,体系3 min内便生成了目标产物3aa,其对映选择性为69.5:30.5。作者通过进一步对联萘酚(BINOL)骨架的3,3'位进行衍生化修饰,得到多种不同芳基取代的IDPi类催化剂。所有催化剂都具有极高的催化活性,在1.0 mol%催化剂的作用下,反应能在30 min内完成。芳基取代基的3,5位修饰长脂肪链可显著提高反应的对映选择性,最终他们发现在C-8催化剂(图3 entry 4至7)的作用下,反应可得到97:3的最佳e.r.值。催化剂负载量降低到0.05 mol%(500 ppm)也不影响反应的产率和对映选择性(entry 8)。作者还考察了其他烯酮缩硅基甲基醇(2a~2d)的反应情况、TBS或TES硅保护基在反应活性和对映选择性方面是最适宜的(entry 8-11)。
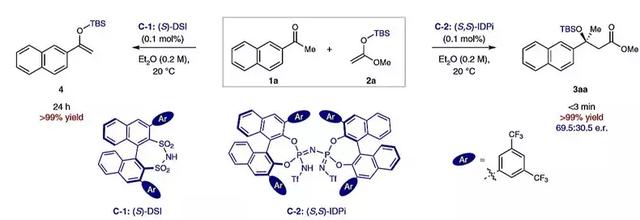
图2. 催化剂C-1和C-2活性的比较。图片来源:Nat. Chem.
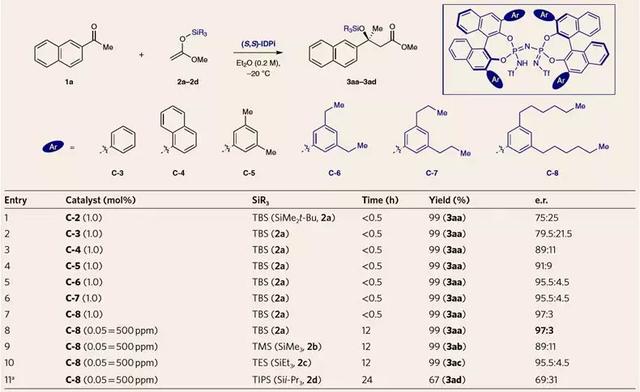
图3. 反应条件的优化。图片来源:Nat. Chem.
有了最佳的反应条件,作者对酮类底物的适用范围(1b-1v)进行考察(图4)。值得注意的是,负载量为0.005~0.05 mol%(50~500 ppm)的催化剂C-4、C-7或C-8在-20 °C的乙醚溶液中反应,能以定量的产率得到所需产物(3b-3v)(>99%),且具有优秀的e.r.值(可达>99:1)。(杂)芳基-烷基酮(1b-1k)、烷基-烷基酮(1m-1o)参与反应也取得了良好的e.r.值(88:12至95:5),炔基酮1p作为底物e.r.值能达到95:5。苄叉丙酮型α,β-不饱和酮1q-1v也具有较高的反应活性,并具有良好的1,2-和1,4-区域选择性(5:1~10:1)和优秀的对映选择性(e.r. = 97.5:2.5至>99:1)。除了甲基酮、乙基酮1c和环状酮1l以外的其他酮类化合物也都能顺利转化为所需的产物3c和3l(e.r. = 94:6和86:14)。
为了说明该方法的实用性,作者对手性叔醇3进行了衍生化。烯酮缩硅基甲基醇2的挥发性极高,而该反应的催化剂负载量极低,因此在减压条件下除去易挥发的反应物后,可以很容易地得到产物3的纯品,不需要进一步的色谱纯化。作者通过一系列衍生化实验,成功获得了β-硅氧基醛5(89%,95:5 e.r.)、二醇6(92%,95:5 e.r.)和7(88%,95:5 e.r.)、羧酸8(91%,95:5 e.r.)、酯交换产物9(84%,95:5 e.r.)和酰胺10(83%,95:5 e.r.)。此外,手性叔醇3p和3u定量转化为产物3n,e.r.值不受影响。
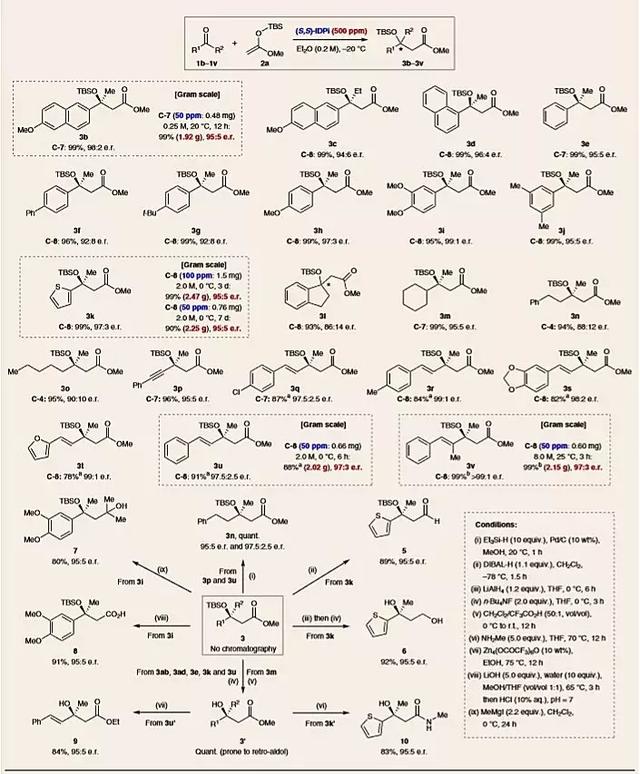
图4. 底物适用范围的考察及产物的衍生化。图片来源:Nat. Chem.
为了进一步探究IDPi催化剂C-8的催化活性,作者还以低负载量的催化剂考察底物3i和3v制备规模的合成实验,以20克量级规模的反应取得了非常高的对映选择性(95:5 e.r.和96:4 e.r.),催化剂负载量分别为25 ppm或2.8 ppm,定量地得到了产物3i(>99%,20.5 g)和3v(92%,20.1 g)。他们还固定酮1u的用量为1.00 g,将催化剂的负载量从8 ppm(0.10 mg)降至2.8 ppm(0.037 mg),反应以几乎定量的产率(~90%)得到产物3u,对映选择性大于95:5。在中,其中仅1.1 mg的C-8就能成功地转化30.0 g底物,得到59.2 g的手性产物(产率86%,TON为~307,000)。作者还研究了加入2.8 ppm催化剂的反应体系重复添加原料的反应情况(图5b)。他们在完成第一反应后去除挥发物质,在不额外添加催化剂的情况下,再加入原料和溶剂,并在相同的条件下进行Aldol反应,最终总转化率为95.2%(产率82%,TON为~911,000)。
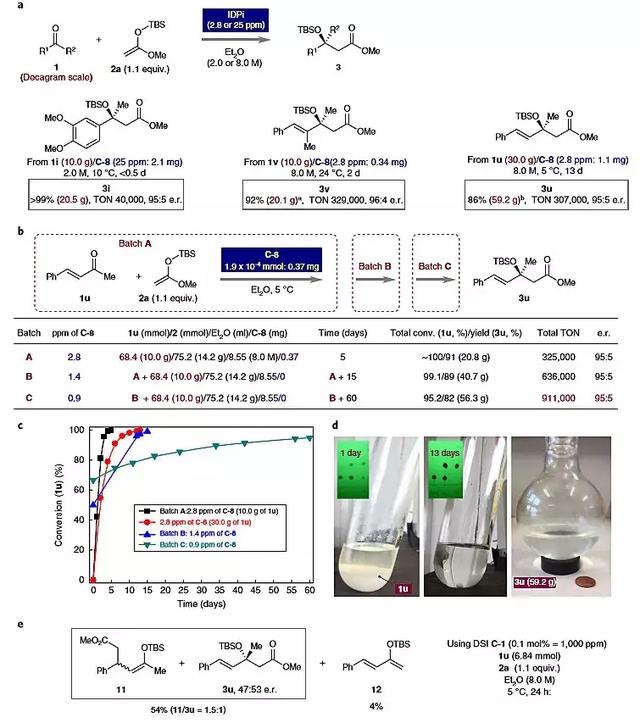
图5. 低催化剂负载量制备规模的反应。图片来源:Nat. Chem.
为了深入了解反应的机理,作者采用原位傅里叶变换红外光谱(图6a)对反应进行了实时分析研究。在0.1 mol%的IDPi催化剂C-6、20 °C的条件下,酮1a在1688 cm-1具有羰基吸收峰。反应7 min后,反应混合物中加入2a(1656 cm-1),反应迅速进行,不到3 min(1H NMR >99%的转化率)便合成了Aldol产物3aa(图6a左,1744 cm-1),e.r.值为95:5。而催化剂C-1并没有完成相应的转化,得到烯醇硅醚4(图6a右,1751 cm-1)。反应结果的显著差异可以通过抗衡阴离子的碱性来解释,作者参照乙腈中的某些非手性酸测定了几种不同手性Brønsted酸催化剂的pKa值,认为IDPi催化剂是一种预催化剂,被2a硅基化形成相应的硅离子对13作为催化反应的Lewis酸,随后硅转移到酮上,形成氧卡宾离子对。DSI阴离子具有足够的碱性,可使氧卡宾离子去质子化,得到相应的烯醇硅烷(pKaDSIC-1 = 8.4)。而IDPi阴离子是一种很弱的碱,可促进所需的Mukaiyama反应发生(pKaIDPiC-3 = 4.5)。
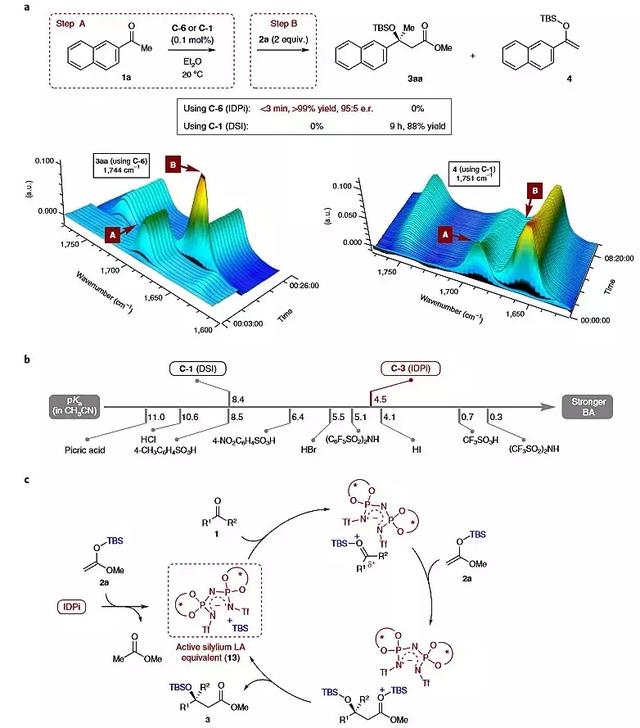
图6. 反应机理的研究。图片来源:Nat. Chem.
总结
Benjamin List教授课题组发展了一种广泛适用于Mukaiyama aldol反应的IDPi催化剂,在该催化剂条件下,各种(杂)芳基-烷基酮和烷基酮能以几乎定量的产率(高达99%)转化为相应的叔醇产物,并具有优秀的对映选择性(高达99:1)。该方法操作简单,底物适用性广泛,所得的产物还可进行多种衍生化。更重要的是,反应通常只需要极低的催化剂负载量,50-500 ppm就足以定量地获得所需的产物,反应时间不到12小时,甚至在某些情况下还可以实现不到1 ppm催化剂负载量的制备反应。这是截至目前,在不对称碳-碳键形成反应中报道的催化剂负载量最低的反应,对于相关方法学的发展及含叔醇结构天然产物的合成具有重要的意义。
原文
2、苄叉丙酮的简介
中文名:苄叉丙酮
化学品名:4-苯基-3-丁烯-2-酮
中文别名:α-苯丁烯-γ-酮;苯丁烯-[1]-酮-[3];苯丁烯酮;苄亚丙酮;甲基苯乙烯基甲酮;甲基苯乙烯基酮;苯亚甲基丙酮;甲基肉桂基甲酮;乙酰苯乙烯;亚苄丙酮;乙酰桂皮酮。
英文别名 1-Phenyl-1-buten-3-one;4-Phenyl-3-buten-2-one;Acetocinnamone;Benzylideneacetone;Cinnamyl methyl ketone;Methyl styryl ketone;Trans-4-phenyl-3-buten-2-one;Trans-4-phenyl-3-butene-2-one;(3E)-4-Phenyl-3-buten-2-one;2-Phenylvinyl methyl ketone;4-phenyl-3-buten-2-one;4-Phenylbut-3-en-2-one;4-Phenylbutenone
分子式:C10H10O
CAS号: 122-57-6
EINECS号:204-555-1
3、苄叉丙酮和二苄叉丙酮的制备实验中有哪些副反应?若碱的浓度偏高时有什么不好?
副反应形成氧负离子中间体,浓度高降低生产率。
实验制备二苄叉丙酮的主反应是羟醛缩合反应,该反应起始于氢氧化钠的氢氧根夺取丙酮的α-氢形成碳负离子,形成的碳负离子作为亲核试剂进攻苯甲醛上的羰基碳,发生加成反应,形成氧负离子中间体,这个中间体再从水中夺取质子生成缩合产物β-羟基醛,并生成氢氧根,同时脱水得到二苄叉丙酮.所以氢氧化钠是该反应的催化剂。
若碱的浓度过高,则氢氧根的浓度过高,不利于反应向生成β-羟基醛的方向进行,从而不利于二苄叉丙酮的生成,降低产率。
化学实验要求:
1、化学实验必须坚持“安全diyi,预防为主”的安全生产方针,认真学习分析规程和有关安全技术规程,了解设备性能,严禁违章作业。
2、在进行化学分析和实验时应严格按照操作规程和安全技术规程进行,掌握对各类事故的处理方法。
3、工作人员应穿工作服。化验室应有自来水,通风设备,消防器材,急救箱,急救酸、碱伤害时中和用的溶液以及毛巾、肥皂等物品。
4、化学实验室应备有防火、防毒用具,并放置在明显处,保持良好的备用状态,化验员要熟知这些器材的使用方法。
5、所有化学试剂、药品、样品必须贴有醒目标签,注明名称、浓度、配制时间以及有效日期,标签字迹要清楚。
6、禁止用手直接接触化学药品和危险物,禁止用口品尝用鼻嗅的方法鉴别物质,如工作需要,必须嗅闻时,可用手微微扇风,头部偏向一侧,并保持一定距离,严禁用烧杯等器皿作餐具式饮水,严禁在化验室饮食。
7、用移液管吸取有毒或腐蚀性液体时,禁止用嘴代替吸球。
8、易挥发或易燃的液体贮瓶,贮放在温度较高的场所瓶内温度较高时,不得立即开瓶,应经冷却后方可开启。
9、易燃、有毒挥发性物质的分析化验工作,必须在通风橱内进行,头部不得伸入橱内。
10、实验工作结束后,所有的仪器设备应放回规定地点。
4、芐叉丙酮能用于镀镍么?
晚上好,苄叉丙酮是一种常见的金属电镀光亮剂,在镀锌、镀镍和镀铬工艺中都有相关应用。苄叉丙酮可以有效提高初期镀镍沉积的光亮度一般配合丁炔二醇化合物或者三苯甲醇共同使用效果更好(一些阴离子表面活性剂亦可复配比如EHS,2-乙基己基硫酸钠)。
本文关键词:苄叉丙酮的用途,苄叉丙酮,苄叉丙酮性状,苄叉丙酮性质,苄叉丙酮的制备装置图。这就是关于《苄叉丙酮的简介,苄叉丙酮的合成(ppm级催化剂负载量的不对称有机催化反应)》的所有内容,希望对您能有所帮助!更多的知识请继续关注《犇涌向乾》百科知识网站:http://www.029ztxx.com!
版权声明: 本站仅提供信息存储空间服务,旨在传递更多信息,不拥有所有权,不承担相关法律责任,不代表本网赞同其观点和对其真实性负责。如因作品内容、版权和其它问题需要同本网联系的,请发送邮件至 举报,一经查实,本站将立刻删除。